[실험] 에탄올 수용액의 partial molar volume을 비중계로 측정한 밀도 이용
 등록일 / 수정일
등록일 / 수정일 페이지 / 형식
페이지 / 형식 자료평가
자료평가 구매가격
구매가격
- 2009.11.26 / 2019.12.24
- 16페이지 /
 hwp (아래아한글2002)
hwp (아래아한글2002) - 평가한 분이 없습니다. (구매금액의 3%지급)
- 1,400원
최대 20페이지까지 미리보기 서비스를 제공합니다.
자료평가하면 구매금액의 3%지급!
 1
1 2
2 3
3 4
4 5
5 6
6 7
7 8
8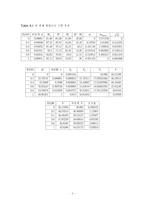 9
9 10
10 11
11 12
12 13
13 14
14 15
15
추천 연관자료
- 목차
-
1. 서 론
1. 1 실험 목적
2. 이론
2. 1 Partial molar quantities
2. 1. 1 부분 몰부피 (Partial molar volume)
2. 1. 2 Chemical Potential
2. 2 이상용액
2. 3 비이상용액
2. 4 Gibbs-Duhem Equation
3. 실험 원리
4. 실험 기구
5. 실험 방법
6. 결과
6. 1 첫 번째 방법
6. 1. 1 계산 방법
6. 1. 2 결과
6. 2 두 번째 방법
6. 1. 1 계산 방법
6. 2. 2 결과 처리
7. 결론
Nomenclature
References
- 본문내용
-
2. 1. 1 부분 몰부피 (Partial molar volume)
어떤 혼합물에서 그 혼합물의 구성 성분인 한 물질 A의 부분 몰부피는 다음과 같이 나타낸다.
혼합물이 A로만 이루어져 있을 경우, 즉 순수한 A로만 이루어진 물질에선 부분 몰부피는 그 물질의 몰부피와 같다.
혼합물에서 부분 몰부피는 몰부피와 같지 않으며, 혼합물의 조성에 의존한다.
A와 B로 이루어진 혼합물이 있다면 일정한 와 에서 다음과 같은 등식이 성립한다.
2. 1. 2 Chemical Potential
Chemical potential 는 부분 몰 Gibbs 에너지로 정의한다. 순수한 물질에서, chemical potential은 다음 식을 만족한다.
A와 B의 두 물질로 이루어진 혼합물에서는 다음과 같이 표시할 수 있다.
순수한 물질은 라는 식을 만족한다. A와 B의 혼합물에서 앞의 식은 다음과 같이 나타낼 수 있다.
압력 와 온도 가 일정하다면, 위 식은 로 나타낼 수 있다. 즉, 조성의 변화는 Gibbs 에너지 변화를 만든다.
2. 2 이상용액
일반적인 2성분계에서 서로 다른 성분 사이에 상호작용을 하지 않는 용액을 일컫는다. Raoult's Law를 만족한다.
- 참고문헌
-
1. 서정목 외 저, “화학공학실험”, 공주대학교 출판부, 공주. (2005)
2. 성기천 외 저, “화학공학실험”, 사이텍미디어, 서울. (2000)
3. 조성일 외 저, “화학공학 기초실험”, 청문각, 파주. (2007)
4. 고려대학교 화공생명공학과, “화공생명기초실험 - 2008년도 2학기”.
5. Peter Atkins and Julio de Paula, ATKINS' Physical Chemistry 8th edition, Oxford University Press, UK (2006)
6. J. M. Smith, H. C. Van Ness and M. M. Abbott, “Introduction to Chemical
Engineering Thermodynamics” 7th edition, McGraw-Hill, NY. (2005)
자료평가
-
아직 평가한 내용이 없습니다.










