화학실험 - 화학 반응 속도
 등록일 / 수정일
등록일 / 수정일 페이지 / 형식
페이지 / 형식 자료평가
자료평가 구매가격
구매가격
- 2015.03.12 / 2015.03.12
- 4페이지 /
 hwp (아래아한글2002)
hwp (아래아한글2002) - 평가한 분이 없습니다. (구매금액의 3%지급)
- 1,200원
최대 20페이지까지 미리보기 서비스를 제공합니다.
자료평가하면 구매금액의 3%지급!
 1
1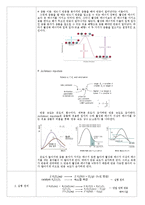 2
2 3
3 4
4
추천 연관자료
- 하고 싶은 말
- 열심히 작성하고 좋은 평을 받은 리포트 입니다.
- 본문내용
-
1. 실험 목적
·반응 속도식과 반응 속도 상수를 이해하고 화학 반응 속도와 반응물의 순간 농도간의 관계를 정립한다.
·화학 반응의 속도식을 나타내는데 필요한 반응 차수와 속도 상수를 실험적으로 결정한다.
<중략>
※ 반응 메커니즘과 속도
반응 메커니즘은 하나 이상의 단일 단계 반응 메커니즘의 합으로 구성되어 있다.
-반응 메커니즘의 조건-
①전체 반응 화학식 = 단일 단계 반응 메커니즘들의 총합
②반응 메커니즘은 실험적으로 결정된 반응 속도식을 만족 시켜야만 한다.
전체 반응 속도는 가장 느린 단일 단계 반응 메커니즘의 속도 보다 빠를 수 없다.
자료평가
-
아직 평가한 내용이 없습니다.
오늘 본 자료
더보기

최근 판매 자료
- [A+] 전자부품, 저항 측정, Bread Board 사용법, 저항의 직렬 병렬연결 예비보고서
- 전공면접, 전공 PT 면접 대비 - 기계공학과 전공 면접 기출자료 & 솔루션
- 음속측정 -기주공명 장치
- A+] 항공기동력장치왕복엔진 구성품의 종류와 그 역할에 대하여 설명하시오
- WirelessLan무선랜
- 무선랜 WirelessLAN2
- 중금속 - 중금속 종류, 체내에 축적되는 경로, 피해현상
- 파이썬의 활용에 대해서
- 영상제작실무 / 유튜브기획안 (영상제작예산안, 영상구성안, 촬영스케줄표, 유튜브구성)
- [금오공대 A+] 일물실 음파의 맥놀이 예비보고서 + 결과보고서
저작권 관련 사항 정보 및 게시물 내용의 진실성에 대하여 레포트샵은 보증하지 아니하며, 해당 정보 및 게시물의 저작권과 기타 법적 책임은 자료 등록자에게 있습니다. 위 정보 및 게시물 내용의 불법적 이용, 무단 전재·배포는 금지됩니다. 저작권침해, 명예훼손 등 분쟁요소 발견시 고객센터에 신고해 주시기 바랍니다.









