일반화학실험 - 화학반응속도 구하기
 등록일 / 수정일
등록일 / 수정일 페이지 / 형식
페이지 / 형식 자료평가
자료평가 구매가격
구매가격
- 2014.05.20 / 2019.12.24
- 6페이지 /
 hwp (아래아한글2002)
hwp (아래아한글2002) - 평가한 분이 없습니다. (구매금액의 3%지급)
- 1,500원
최대 20페이지까지 미리보기 서비스를 제공합니다.
자료평가하면 구매금액의 3%지급!
 1
1 2
2 3
3 4
4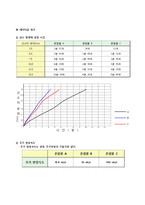 5
5 6
6
추천 연관자료
- 하고 싶은 말
- 열심히 작성하고 좋은 평을 받은 리포트 입니다. 좋은 결과 있으시길 바랍니다.
- 본문내용
-
화학반응에 영향을 미치는 요인에는 농도, 온도, 촉매가 있다. 그 중 반응물의 농도증가는 반응물의 입자수를 증가시키고 입자수가 증가함으로 반응물끼리의 충돌횟수가 증가하게 되어 결과적으로 화학반응속도가 증가하게 되는 것이다. 즉, 입자수의 증가는 농도의 증가를 불러오고 그것은 충돌횟수의 증가, 곧 화학반응 속도의 증가라 할 수 있다.
○ 반응속도와 농도
반응 속도는 물질을 분자적 관점으로 보아 두 분자가 반응하기 위하여 서로 접근해서 계속적으로 충돌할 때 화학 반응이 일어난다는 충돌 이론이 지배적이다. 따라서, 반응 물질의 농도가 증가하면 충돌의 기회가 증가하여 반응 속도가 빨라진다.
일정한 부피 속에 들어 있는 반응에 참여하는 입자, 즉 원자, 이온 등의 수가 증가하면 분자간의 충돌이 빈번해질 것이고, 따라서 유효 충돌이 많아지면 활성화 착물이 많아져서 반응 속도는 빨라질 것이다.
일반적으로 반응속도는 반응 물질의 농도에 의존하기 때문에 다음과 같은 속도식으로 표현한다.
aA + bB -> cC + dD
k= Rate constant (온도에 의존) m ,n = Reaction order (실험을 통해서만 결정)
이 실험에서는 과산화수소(H2O2)가 물과 산소 기체로 분해되는 반응 속도를 측정한다. 이 분해 반응의 속도는 상온에서 매우 느리지만 KI를 촉매로 넣어주면 반응 속도가 상당히 빨라진다.
자료평가
-
아직 평가한 내용이 없습니다.
오늘 본 자료
더보기

최근 판매 자료
- 물리화학 보고서- Conjugation 염료의 흡수 스펙트럼
- 일반물리학 실험 - 일과 에너지 결과보고서
- 디지털 회로 실험 및 설계 - ADC(Analog to Digital Converter) 실험 1
- [도로교통] 도로 폭에 따른 구간 내 LOS 분석
- [나노기술]나노기술의 정의와 응용분야 및 발전방향(A+레포트)★★★★★
- [도로교통] 도로 폭에 따른 구간 내 LOS 분석
- [창의공학] 계단 오르는 유모차 문제점 및 해결방안
- 모발 염색의 종류와 원리
- [조경실무]조경실무 - 도시경관의 문제점과 발전방향
- 바이오인포매틱스(생물정보학)개념, 바이오인포매틱스(생물정보학)정보과학적기법, 바이오인포매틱스(생물정보학)현황, 바이오인포매틱스 과제
저작권 관련 사항 정보 및 게시물 내용의 진실성에 대하여 레포트샵은 보증하지 아니하며, 해당 정보 및 게시물의 저작권과 기타 법적 책임은 자료 등록자에게 있습니다. 위 정보 및 게시물 내용의 불법적 이용, 무단 전재·배포는 금지됩니다. 저작권침해, 명예훼손 등 분쟁요소 발견시 고객센터에 신고해 주시기 바랍니다.









