[화학] Enzyme Kinetics(효소반응 속도론)
 등록일 / 수정일
등록일 / 수정일 페이지 / 형식
페이지 / 형식 자료평가
자료평가 구매가격
구매가격
- 2009.08.29 / 2019.12.24
- 40페이지 /
 hwp (아래아한글2002)
hwp (아래아한글2002) - 평가한 분이 없습니다. (구매금액의 3%지급)
- 2,800원
최대 20페이지까지 미리보기 서비스를 제공합니다.
자료평가하면 구매금액의 3%지급!
 1
1 2
2 3
3 4
4 5
5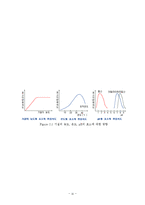 6
6 7
7 8
8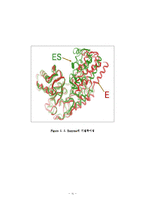 9
9 10
10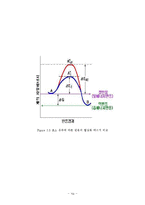 11
11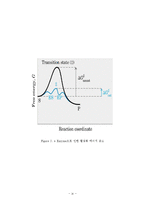 12
12 13
13 14
14 15
15 16
16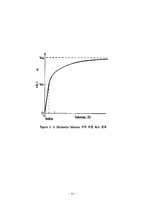 17
17 18
18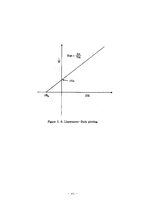 19
19 20
20
추천 연관자료
- 목차
-
Abstract
1. 서 론
1.1 실험 목적
2. 이론적 배경
2. 1 효소(Enzyme)
2. 2. 1 효소의 정의와 특성
2. 2 효소의 원리
2. 2. 1 기질특이성
2. 2. 2 활성화 에너지
2. 3 Enzyme Kinetics
2. 3. 1 단순 효소 속도론
2. 3. 2 Michaelis-Menten 속도식의 속도상수의 결정
2. 4 트립신
2. 4. 1. Trypsin의 펩타이드 결합 분해.
3. 실험방법
3.1 Equipment
3.2 Reagent
3.3 Procedure
- 본문내용
-
1. 서 론
1.1. 실험 목적
트립신(Trypsin)은 이자액에서 분비되는 단백질 분해효소로 단백질의 소화에 있어서 펩신과 함께 가장 중요한 효소이다. 효소는 기질과 결합하여 효소-기질 복합체(enzyme-substrate complex)를 형성함으로써 반응의 활성화 에너지(activation energy)를 낮추는 촉매 역할을 한다.
어떤 물질들이 모여서 화학반응을 하려면 이 물질들이 서로 결합하거나 충돌할 만큼 에너지를 가져야 하는데, 이런 상태가 되는 데 필요한 에너지를 그 물질의 활성화 에너지라 한다. 효소는 이런 활성화 에너지를 낮추어 줌으로써 생물체 내의 화학반응을 촉진시킨다.
이번 실험에서는 효소의 특성과 효소의 반응속도론(Enzyme kinetics)에 대한 이론지식을 밑바탕으로 미카엘리스-멘텐동역학(Michaelis-Menten kinetics)모델을 이용하여 트립신(Trypsin)의 반응속도상수 (Kinetic parameter)와 최대 반응속도(Vmax)를 측정하는 것이 목적이다. 용액의 농도는 분광광도계(Spectrophotometer)를 사용하여 구한다.
2. 이론적 배경
2. 1 효소(Enzyme)
2.1.1 효소의 정의와 특성
모든 화학반응은 반응 물질 외에 미량의 촉매가 존재함으로서 반응속도가 현저하게 커지는데, 생물체 내에서도 모든 화학반응이 이 촉매에 의해 속도가 빨라진다. 다만 반응의 촉매와는 달리 생물체 내의 촉매는 모두가 단백질이다. 따라서 생물체 내의 촉매를 특히 효소라고 한다.
효소는 단백질이기 때문에 무기 촉매와는 달리 온도나 pH등 환경 요인에 의하여 기능이 크게 영향을 받는다. 즉 모든 효소는 특정한 온도 범위 내에서 활성이 가장 크게 나타난다. 대개의 효소는 온도가 35℃~45℃에서 활성이 가장 크다. 이것은 온도가 올라가면 화학반응 속도가 일반적으로 커짐에 따라 효소의 촉매작용도 커지지만, 온도가 일정 범위를 넘으면 화학반응 속도는 커져도 단백질의 분자 구조가 변형을 일으켜 촉매 기능이 떨어지기 때문이다. 또 효소는 pH가 일정 범위를 넘으면
자료평가
-
아직 평가한 내용이 없습니다.
오늘 본 자료
더보기

최근 판매 자료
- 물리화학 보고서- Conjugation 염료의 흡수 스펙트럼
- 일반물리학 실험 - 일과 에너지 결과보고서
- 디지털 회로 실험 및 설계 - ADC(Analog to Digital Converter) 실험 1
- [도로교통] 도로 폭에 따른 구간 내 LOS 분석
- [나노기술]나노기술의 정의와 응용분야 및 발전방향(A+레포트)★★★★★
- [도로교통] 도로 폭에 따른 구간 내 LOS 분석
- [창의공학] 계단 오르는 유모차 문제점 및 해결방안
- 모발 염색의 종류와 원리
- [조경실무]조경실무 - 도시경관의 문제점과 발전방향
- 바이오인포매틱스(생물정보학)개념, 바이오인포매틱스(생물정보학)정보과학적기법, 바이오인포매틱스(생물정보학)현황, 바이오인포매틱스 과제
저작권 관련 사항 정보 및 게시물 내용의 진실성에 대하여 레포트샵은 보증하지 아니하며, 해당 정보 및 게시물의 저작권과 기타 법적 책임은 자료 등록자에게 있습니다. 위 정보 및 게시물 내용의 불법적 이용, 무단 전재·배포는 금지됩니다. 저작권침해, 명예훼손 등 분쟁요소 발견시 고객센터에 신고해 주시기 바랍니다.









