[분석화학, 일반 화학] 산, 염기 표준 용액 만들기와 표정
 등록일 / 수정일
등록일 / 수정일 페이지 / 형식
페이지 / 형식 자료평가
자료평가 구매가격
구매가격
- 2009.03.30 / 2019.12.24
- 4페이지 /
 hwp (아래아한글2002)
hwp (아래아한글2002) 



 1건 (구매금액의 3%지급)
1건 (구매금액의 3%지급)- 500원
최대 20페이지까지 미리보기 서비스를 제공합니다.
자료평가하면 구매금액의 3%지급!
 1
1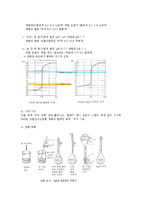 2
2 3
3 4
4
추천 연관자료
- 하고 싶은 말
-
분석 실험시 제출 했던 실험 보고서 입니다.
사진도 있으니 좋은 자료가 될꺼에요 결과도 있고 ㅋㅋㅋ
- 목차
-
1). 실험 목적
2).실험 원리
* 농도 % 농도 몰농도몰랄 농도 * 중화 반응* 적정법등등.....
3). 시약 기구
4). 실험 방법
5).주의사항
1.정확한 종말점 찾기~ 6. NaOH⇒ 조해성 : 질량 측정시 빠르게 공기중 CO2 흡수 -> 용액을 만든 후 밀폐 보관
6) 예측 결과
7)결과
1. NaOH 표정 (0.1M 2당량 옥살산 25 ml)
2.HCL표정 (HCL 25ml)
8) 참고 문헌
- 본문내용
-
1). 실험 목적
메스플라스크를 이용하여 산, 염지 적정의 당량점 or 농도를 결정하고 표준 용액을 만들어 본다.
지시약의 변화를 관찰하여 산, 염기 적정을 습득 한다.
2).실험 원리
* 농도 : 일정량의 용액속에 포함 되어 있는 용질의 양
% 농도 = 용질의 질량/ 용액의 질량 *100 : 용액의 온도가 변하더라도 용액의 % 농도 변함 없음
몰농도(M)= 용질의 몰수 (mol)/ 용액의 부피(l): 같은 용액이라도 온도가 변하면 M이 약간씩 변함 (온도에 따라 용액의 부피가 변함)
몰랄 농도 (m)= 용질의 몰수 (mol)/용매의 질량 (kg) : 온도. 압력변화에 관계 없이 일정하다.
* 중화 반응: 산과 염기 사이에서 일어나는 반응
산+염기 -> 염(salt)+ 물 or 다른 생성물
염기가 수화물인 경우의 product
cf) 노르말 농도: 용액의 1l속에 녹아 있는 용질의 g 당량수를 나타낸 농도
* 당량: 수소 한 원자량과 대등하게 작용 할 수 있는 원소의 분량
16O + 2H -> O의 당량 :8
* 적정법
자료평가





- 제가 찾던 자료인줄 알았는데 안의 내용이 약간 찾던 내용과 벗어났지만 그래프나 그림, 설명은 좋았습니다.
- ala***
(2015.03.26 20:19:30)
오늘 본 자료
더보기

최근 판매 자료
- [조경실무]조경실무 - 도시경관의 문제점과 발전방향
- 바이오인포매틱스(생물정보학)개념, 바이오인포매틱스(생물정보학)정보과학적기법, 바이오인포매틱스(생물정보학)현황, 바이오인포매틱스 과제
- [생물학] 유전자와 돌연변이
- 디지털 회로 실험 및 설계 - ADC(Analog to Digital Converter) 실험 1
- 회로이론1 이정훈 년도 표기
- 회로이론1 이정훈 년도 표기 X
- 연세대 고려대 성균관대 한양대 기계공학 대학원 구술면접자료 및 공부
- 전자기학 응용예제_04장 hayt
- [생화학 실험] TLC를 이용한 아미노산의 적정실험
- 광결정(Photonic crystal)
저작권 관련 사항 정보 및 게시물 내용의 진실성에 대하여 레포트샵은 보증하지 아니하며, 해당 정보 및 게시물의 저작권과 기타 법적 책임은 자료 등록자에게 있습니다. 위 정보 및 게시물 내용의 불법적 이용, 무단 전재·배포는 금지됩니다. 저작권침해, 명예훼손 등 분쟁요소 발견시 고객센터에 신고해 주시기 바랍니다.









