화학반응속도 -시계반응
 등록일 / 수정일
등록일 / 수정일 페이지 / 형식
페이지 / 형식 자료평가
자료평가 구매가격
구매가격
- 2009.07.23 / 2019.12.24
- 23페이지 /
 hwp (아래아한글2002)
hwp (아래아한글2002) - 평가한 분이 없습니다. (구매금액의 3%지급)
- 2,100원
최대 20페이지까지 미리보기 서비스를 제공합니다.
자료평가하면 구매금액의 3%지급!
 1
1 2
2 3
3 4
4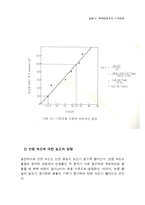 5
5 6
6 7
7 8
8 9
9 10
10 11
11 12
12 13
13 14
14 15
15 16
16 17
17 18
18 19
19 20
20
추천 연관자료
- 목차
-
1. 실험목적
2. 실험도구
1) 기구
1) 시약
3. 이론
1) 시계반응
2) 반응속도에 대한 농도의 영향
3) 반응속도식 / 반응속도상수 / 반응차수
4) 녹말 지시약
5) 활성화 에너지(Ea)
6) 시약 조사
4. 주의 및 참고사항
5. 실험방법
6. 자료 및 결과
1) 실험 결과
7. 결론
8. 참고문헌
- 본문내용
-
실험14 화학반응속도-시계반응
실험14. 화학반응속도-시계반응
1. 목적
화학반응속도는 농도, 온도 및 촉매의 영향을 받는다. 농도 변화에 따른 반응속도를 측정함으로써 반응속도상수와 반응차수를 결정할 수 있다. 일 실험에서는 소위 시계반응을 이용하여 2I¯ + S2O8²¯ → I2 + 2SO4²¯ 반응의 속도에 미치는 농도의 영향을 조사하고, 반응속도상수 및 반응차수 구하는 방법을 습득한다.
2. 실험 도구
기구:삼각플라스크(50mL, 100mL), 피펫(5mL, 10mL, 20mL), 눈금실린더 (10mL), 온도계(1-100℃), 고무빨게, 초시계, 스포이드, 씻기병.
시약:0.2M KI, 0.1M(NH4)2S2O8, 0.005M Na2S2O3, 0.2M KCl, 0.1M (NH4)2SO4, 녹말지시약(녹말+HgCl2)
3. 이론
1) 시계반응
이 실험에서는 화학반응속도에 미치는 농도의 영향을 조사하는 것이 목적이다. 다음과 같은 요오드화 이온과 과산화이황산 이온의 반응을 조사하여 보자.
I¯ + S2O8²¯ → I2 + 2SO4²¯
(1)
이 반응은 실온에서는 상당히 느리게 진행되는데, 그 반응속도는 다음 식으로 나타낼 수 있다.
반응속도=k[I¯][S2O8²¯]ⁿ
(2)
여기서 k는 반응속도상수이며, m과 n은 반응차수로서 0, 1, 2, 3과 같은 정수이다. 이온의 농도는 mol/L로 나타낸다. 반응속도는 식 (2)에서 알 수 있듯이 반응물의 농도에 따라서 영향을 받는다. 또한 반응속도는 온도와 촉매의 영향을 받는다. 그러나 이 실험에서는 반응속도에 미치는 농도의 영향만을 조사하기로 한다.
이 실험의 주목적은 속도상수 k의 값과 반응차수 m과 n을 구하는 것이다. 우리들이 반응속도를 측정하려는 방법은 소위 시계반응이라 부르는 반응인데, 이것은 한 반응의 종말점을 자동적으로 알 수 있는 반응이다. 우리가 조사대상으로 하고 있는 반응 (1)을 녹말 존재하에서 다음의 반응 (3)과 동일 용기내에서 동시에 일어나도록 한다.
I2 + 2S2O3²¯ → 2I¯ + S4O6²¯
(3)
반응 (3)응 반응 (1)에 비하여 훨씬 빨리 진행된다. 그러므로 반응 (1)에서 생성된 I2분자는 같은 반응요기에 들어 있던 S2O3²¯ 이온과 재빨리 반응하여 없어지게 되어 S2O3²¯ 이온이 완전히 소모되지 않는 한 I2의 농도는 영이다. 반응이 진행되어 S2O3²¯ 이온이 모두 소모되면 반응 (1)만이 일어나므로 I2
- 참고문헌
-
ꋯ표준일반화학 실험[제 5 판]
대한 화학회, 천문각 1999.
ꋯ일반화학
일반화학교재연구회, 천문각
ꋯ일반화학[제 7 판]
Brown LeMay Bursten, 녹문당
ꋯ화학의 세계
화학교재편찬위원회, 지샘 1999.
ꋯ일반화학[제 7 판]
Raymond Chang chemistry, 자유 아카데미
자료평가
-
아직 평가한 내용이 없습니다.
오늘 본 자료
더보기

최근 판매 자료
- [조경실무]조경실무 - 도시경관의 문제점과 발전방향
- 바이오인포매틱스(생물정보학)개념, 바이오인포매틱스(생물정보학)정보과학적기법, 바이오인포매틱스(생물정보학)현황, 바이오인포매틱스 과제
- [생물학] 유전자와 돌연변이
- 디지털 회로 실험 및 설계 - ADC(Analog to Digital Converter) 실험 1
- 회로이론1 이정훈 년도 표기
- 회로이론1 이정훈 년도 표기 X
- 연세대 고려대 성균관대 한양대 기계공학 대학원 구술면접자료 및 공부
- 전자기학 응용예제_04장 hayt
- [생화학 실험] TLC를 이용한 아미노산의 적정실험
- 광결정(Photonic crystal)
저작권 관련 사항 정보 및 게시물 내용의 진실성에 대하여 레포트샵은 보증하지 아니하며, 해당 정보 및 게시물의 저작권과 기타 법적 책임은 자료 등록자에게 있습니다. 위 정보 및 게시물 내용의 불법적 이용, 무단 전재·배포는 금지됩니다. 저작권침해, 명예훼손 등 분쟁요소 발견시 고객센터에 신고해 주시기 바랍니다.









