단백질 분리정제
 등록일 / 수정일
등록일 / 수정일 페이지 / 형식
페이지 / 형식 자료평가
자료평가 구매가격
구매가격
- 2006.07.25 / 2019.12.24
- 16페이지 /
 doc (MS워드 2003이하)
doc (MS워드 2003이하) - 평가한 분이 없습니다. (구매금액의 3%지급)
- 1,400원
최대 20페이지까지 미리보기 서비스를 제공합니다.
자료평가하면 구매금액의 3%지급!
 1
1 2
2 3
3 4
4 5
5 6
6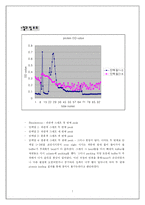 7
7 8
8 9
9 10
10 11
11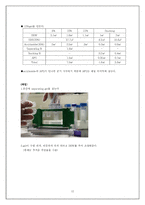 12
12 13
13 14
14 15
15 16
16
추천 연관자료
- 목차
-
왜 단백질을 분리하여만 하는가?
-실험에 들어가기에 앞서……
-to make buffer
-실험 과정
-주의사항
- 단백질 OD값 측정 결과
-결과 및 토의
SDS 전기영동
-전기영동의 목적-
-SDS Page의 원리-
-실험 들어가기에 앞서-
-Staking gel(PH 6.8) 의 구성 성분들의 역할과 기작
- Separating gel (pH8.8)의 구성성분들의 역할 및 작용 기작
결과분석
Discussion
- 본문내용
-
왜 단백질을 분리하여만 하는가?
단백질 분리는 proteomics, drug 발견과 생산에 매우 중요한 일이다.
이런 모든 분야에서 반드시 sample preparation, protein identification, characterization, purification등이 포함된다.
Proteomics나 혹은 발현된 단백질의 기능 연구하는 경우에 단백질 분리는 필수적이다.
“Workhorse of proteomics”라고 불리는 2-D gel electrophoresis는 먼저 단백질의 pl에 의해 분리하고, 2차로 크기에 의해 분리하는 가장 일반적 방법이다.
신약 개발 시 단백질 분리는 반드시 필요하며 제약회사나 Bio tech 회사들은 전기영동과 Chromatography 방법을 사용하여 새로운 단백질을 찾고 특정 질병을 치료할 수 있는 물질을 찾고 있다.
자료평가
-
아직 평가한 내용이 없습니다.










