유전자 재조합 단백질 Endostatin의 생산 공정 설계
 등록일 / 수정일
등록일 / 수정일 페이지 / 형식
페이지 / 형식 자료평가
자료평가 구매가격
구매가격
- 2015.06.01 / 2015.06.01
- 62페이지 /
 docx (MS워드 2007이상)
docx (MS워드 2007이상) - 평가한 분이 없습니다. (구매금액의 3%지급)
- 1,200원
최대 20페이지까지 미리보기 서비스를 제공합니다.
자료평가하면 구매금액의 3%지급!
 1
1 2
2 3
3 4
4 5
5 6
6 7
7 8
8 9
9 10
10 11
11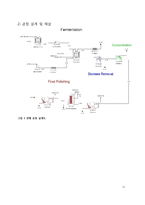 12
12 13
13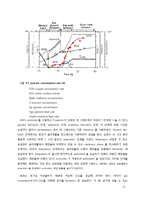 14
14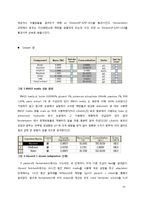 15
15 16
16 17
17 18
18 19
19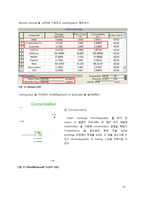 20
20
추천 연관자료
- Human Endostatin 합성 공정 설계 경과 보고
- [다양한 직업] 생물공학기술자, 환경공학기술자, 철도기관사, 애견미용사, 캐디, 항공정비사, 데이터베이스관리자, 시스템프로그래머, 웹마스터, 조주사, 오퍼레이션리서치분석가에 관하여
- [생산][생산입지][생산기술][생산가격][생산지수][생산운영][생산조직][생산구조][생산시설]생산입지, 생산기술, 생산가격, 생산지수, 생산운영, 생산조직, 생산구조, 생산시설(생산, 생산입지, 생산기술, 생산가격)
- 미원의 탄생
- [생명공학][생명공학기술][생명공학산업][바이오][생물산업]생명공학의 정의, 특징, 중요성, 발전추세와 생명공학의 장점, 연구 동향 및 생명공학 연구개발기반 확충 그리고 향후 생명공학기술개발 전망 분석
- 목차
-
1. 배경
(1) Endostatin이란
(2) Endostatin의 구조
(3) Endostatin의 메커니즘과 의학적 효용성
(4) 신생 혈관 생성 억제제의 시장조사
2. 공정 설계
(1) Process1-E. coli
1) 공정 개요
2) 공정 설계 및 해설
3) 경제성 평가⑥ IMAC2
(2) Process2-P. pastoris
1) 공정 개요
2) 공정 설계 및 해설
① Fermentation
② Biomass removal
③ Concentration
④ Final polishing
⑤Scheduling
3) 경제성 평가
(3) Process3-Trichoplusia ni
1) 공정 개요
2) 공정 설계 및 해설
① Fermentation
② Biomass removal
③ Concentration
④ IMAC1
⑤ His-tag cleavage
⑥Scheduling
3) 경제성 평가
3. 결과 분석 및 토의
4. 참고 문헌
- 본문내용
-
1. 배경
(1) Endostatin이란
암은 그 치료의 어려움때문에 인류가 해결해야할 난제로 여겨져 왔다. 암이란 발암물질, 바이러스 또는 유전적 변이로 인해 비정상적으로 증식한 세포의 덩어리이다. In vivo에서의 암의 특징으로 나타나는 점은 조절되지 않은 증식을 하고, apoptosis를 하지않으며 자체적으로 혈관생성을 하고 이동성이 있어 혈관등을 타고 다른 조직으로 이동가능하다는 것이다. 특히, 고형암의 증식과 전이는 신생 혈관생성(angiogenesis)에 크게 의존하고 있으며, 따라서 암 치료의 핵심적인 요소로서 혈관신생 억제물질의 개발이 진행되어왔다. 최초의 혈관신생 억제제로는 엔지오스테틴(angiostatin)과 크링글-5(kringle-5)이 있다.
그 후에 근래에 들어 조명을 받게 된 혈관신생 억제제는 엔도스테틴(endostatin)이라는 단백질이다. Endostatin은 동물에서 종양의 혈관생성을 억제(angiogenesis inhibitor)하는 단백질이다. 이를 통해 암의 증식과 전이를 막고, 출혈로 인한 복수의 형성을 억제하는 기능을 한다. 암의 숙주에 Endostatin을 주입하는 것은 췌장의 암의 증식과 간으로의 전이를 막는데에 효과가 있는것으로 여겨진다. 일련의 실험을 통해 혈관생성세포에 주입한 endostatin은 미세 fillament의 형성을 억제하여 혈관생성을 저해하는 기능이 있음이 밝혀졌다. 그러한 기능을 통해 hamster에 주입한 endostatin이 tumor cell의 증식과 전이를 막고 복수가 차는 것을 방지하는 데에 효과가 있음을 밝혀내었다. 또한, 전이성 종양의 증식 저해제로 작용할 뿐만 아니라 전이능이 없는 초기 암세포에 대해서도 증식 억제능이 확인되고 있으며, 여러 번의 치료 주기에도 내성이 생기지 않는다는 성질을 보인다.
엔도스테틴은 콜라겐타입-18의 분자량 20-kDa의 C-말단 단편에 해당하는 약 180개의 아미노산으로 이루어진 폴리펩티드이다. 콜라겐타입-18은 콜라겐유사 단백질 군에 해당하며 혈관벽에 주로 존재한다. 생성 기전은 완전히 밝혀지진 않았지만, 이 콜라겐타입-18을 생체 내의 단백질 분해효소로 절단하여 엔도스테틴을 얻을 수 있으며, 종양을 가진 생쥐의 생체 안에서도 발견된다.
- 참고문헌
-
(1) 이상기, “재조합 단백질 발현 시스템의 연구개발 동향”, 한국미생물•생명공학회(2002), Vol. 15 No. 4, pg12-16
(2) Eugene H. Wegner, “Biochemical Conversions by Yeast Fermentation at High Cell Densities”, US patent 4414329, 1983 (특허)
(3) Joseph Shiloach et al. “Endostatin capture from Pichia pastoris culture in a fluidized bed from on-chip process optimization to application”, Journal of Chromatography B, 790 (2003), pg327-336
(4) Mehmedalija Jahic et al. “Process Technology for Production and Recovery of Heterologous Proteins with Pichia pastoris”, Biotechnology Prog.(2006), pg1465-1473
(5) L. B. Trinh et al. “Effect of Methanol Feeding Strategies on Production and Yield of Recombinant Mouse Endostatin from Pichia pastoris”, Biotechnology and Bioengineering, vol. 82 (2003), pg438-444
(6) Mohanraj Dhanabal et al. "Cloning, Expression, and in vitro Activity of Human Endostatin", Ideal(1999)
(1) Hong min Lee, 『Production of recombinant endostatin from stably transformed Trichoplusia ni BTI Tn 5BI-4 cells』, 2001, Biotechnology letters Vol.23
(2) Michael S. Donaldson and Michael L. Shuler공저, 『Low-Cost Serum-Free Medium for the BTI-Tn5B1-4 Insect Cell Line』, 1998, Biotechnol Prog Vol.14
(3) Stefano Pieraccini, 『A molecular dynamics study of human endostatin and its synthetic fragments with antiangiogenic properies』, 2006, www.rsc.org/pccp
(4) 『Novagen Inc. His-bind kit user manual』, Novagen, 2003
(5) 『Purifying His-tagged proteins on FPLC 』,Johns Hopkins University , 2011, www.jhu.edu/fleming/Local/Protocols/His_tagged_proteins.docx,
(6) Zhijian Su, 『High level expression of human endostatin in Pichia pastoris using a synthetic gene construct』, 2006, Springer-Verlag
(7) Helena Block, 『Immobilized-Metal Affinity Chromatography (IMAC): A Review』, 2009, Methods in Enzymology
(8) David S Waugh (NCI), 『Recombinant BoCPB: An Enzymatic reagent for removing disordered, positively charged C-terminal residues from recombination proteins』, 2011, Whitney Hastings
시장조사 레퍼런스
“대우제약, 6천억 시장 혈관신생억제 표적항암제 개발”, 약업신문, 2012-05-10, http://www.yakup.com/news/index.html?mode=view&cat=12&nid=152468
자료평가
-
아직 평가한 내용이 없습니다.










