물리화학실험 - 분광광도계를 이용한 약산의 평형상수 결정
 등록일 / 수정일
등록일 / 수정일 페이지 / 형식
페이지 / 형식 자료평가
자료평가 구매가격
구매가격
- 2015.04.27 / 2015.04.27
- 4페이지 /
 docx (MS워드 2007이상)
docx (MS워드 2007이상) - 평가한 분이 없습니다. (구매금액의 3%지급)
- 1,200원
최대 20페이지까지 미리보기 서비스를 제공합니다.
자료평가하면 구매금액의 3%지급!
 1
1 2
2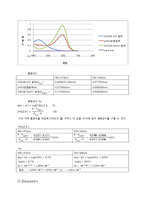 3
3 4
4
추천 연관자료
- 하고 싶은 말
- 열심히 작성하고 좋은 평을 받은 리포트 입니다.
- 본문내용
-
실험요약: 0.001M HCl 용액, 0.001M NaOH 용액을 만들고 티몰블루 용액을 0.001M HCl 용액, 0.001M NaOH 용액, Ph 9.0 완충용액에 넣는다. 그리고 큐벳 5개에 base라인을 측정할 증류수 2개와 아까 만든 용액 3개를 넣고 파장 400nm~700nm사이에서 분광광도계를 이용해 측정한다. 결과로 나온 흡수스펙트럼을 가지고 약산의 평형상수를 구할 수 있다.
Ⅰ. Introduction
실험제목 : 분광광도계를 이용한 약산의 평형상수 결정
실험목적
분광광도계 사용법과 그 원리를 이해한다.
분광광도계 측정후 나온 데이터를 그래프로 그리고 흡광도 값을 찾아 약산의 평형상수를 구한다.
Theory
Beer의 법칙
농도 c인 용액에 대한 입사광의 세기를 P_0 , 투과광의 세기를 P라고 하면 투광도 T , 흡광도 A, %T는 다음과 같이 정리된다.
T≡P/P_0
A≡log(P/P_0) = -logT
%T≡T×100
그러면 다음과 같은 Beer의 법칙이 성립한다.
- 참고문헌
-
“thymol blue”, http://en.wikipedia.org/wiki/Thymol_blue, 2014.10.25. 검색
“hydrogen chloride”, http://en.wikipedia.org/wiki/Hydrogen_chloride, 2014.10.25. 검색
“Sodium chloride” http://en.wikipedia.org/wiki/Sodium_chloride, 2014.10.25. 검색
Atkins, 『물리화학』,안운선,8판,p457
자료평가
-
아직 평가한 내용이 없습니다.










