회분식 반응기를 이용한 반응속도 상수의 결정
 등록일 / 수정일
등록일 / 수정일 페이지 / 형식
페이지 / 형식 자료평가
자료평가 구매가격
구매가격
- 2012.03.19 / 2019.12.24
- 8페이지 /
 hwp (아래아한글2002)
hwp (아래아한글2002) 



 2건 (구매금액의 3%지급)
2건 (구매금액의 3%지급)- 1,000원
최대 20페이지까지 미리보기 서비스를 제공합니다.
자료평가하면 구매금액의 3%지급!
 1
1 2
2 3
3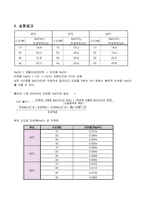 4
4 5
5 6
6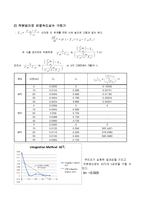 7
7 8
8
추천 연관자료
- 목차
-
목 차
1. 실험목적
2. 실험이론
1) 반응속도식
2) 미분법
3) 적분법
3. 실험 방법
1) 준비물
2) 시약제조
3) 실험 과정
4. 실험결과
1) 미분법으로 반응속도 상수(k)구하기
2) 적분법으로 반응속도상수 구하기
- 본문내용
-
3. 실험 방법
1) 준비물
항온수조, 교반기, 500ml 3구 플라스크 1개, 500ml와 300ml 삼각플라스크 각 1개, 25ml 피펫, 뷰렛, o.o3 mol/l NaOH, o.o2 mol/l ethyl acetate 수용액, o.o5N HCl 수용액, o.o5N Ba(OH)2 수용액 , phenolphtaleine
2) 시약제조
① NaOH 0.03mol/L 제조
0.03mol/1000ml × 40g/mol × 500ml = 약 0.6g
→ NaOH 0.6g에 증류수를 가해 500ml 용액을 만든다.
② CH3COOC2H5 0.02mol/L 제조
0.02mol/1000ml × 88.11g/mol × 1ml/0.879g(밀도) × 500ml = 약 1ml
→ CH3COOC2H5 1ml에 증류수를 가해 500ml 용액을 만든다.
③ HCl 0.05N 제조
0.05mol/1000ml × 36.46g/1mol × 1ml/1.18g(비중) × 1/0.35 × 500ml
= 약 2.206 ml
→ HCl 약 2.2ml에 증류수를 가해 500ml 용액을 만든다.
④ (Ba)OH2-8H2O 0.05N
(Ba)OH2-8H2O: 분자량 315.48g/mol, 2당량
(Ba)OH2-8H2O 0.05N 에서
0.05mol/1000ml × 1/2당량 × 315.48g/1mol × 500ml = 약3.94g
(Ba)OH2-8H2O 약 3.94g에 증류수를 가해 500ml 용액을 만든다.
자료평가





- 원하는자료가없습니다.......
- pche***
(2014.11.28 20:26:22)





- dasdsadsadsad
- d1***
(2014.10.08 02:28:49)










