[화학공학실험] pH미터가 달린 칼로멜-유리전극을 이용한 전위차 적정법
 등록일 / 수정일
등록일 / 수정일 페이지 / 형식
페이지 / 형식 자료평가
자료평가 구매가격
구매가격
- 2010.11.09 / 2019.12.24
- 25페이지 /
 hwp (아래아한글2002)
hwp (아래아한글2002) - 평가한 분이 없습니다. (구매금액의 3%지급)
- 2,400원
최대 20페이지까지 미리보기 서비스를 제공합니다.
자료평가하면 구매금액의 3%지급!
 1
1 2
2 3
3 4
4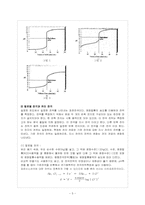 5
5 6
6 7
7 8
8 9
9 10
10 11
11 12
12 13
13 14
14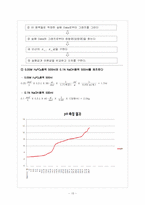 15
15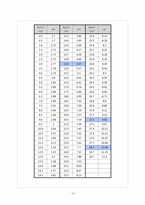 16
16 17
17 18
18 19
19 20
20- 목차
-
1. 실험 목적
2. 실험 이론
3. 실험 기구 및 시약
4. 실험 방법
5. 실험 Data 처리
6. 결과 및 분석
7. 토의
8. 고찰
9. 참고문헌
- 본문내용
-
❋ pH미터기 보정법
① pH 7.01과 pH 4.01 또는 pH 10.01 용액을 비커 안에 소량 준비한다.
만일 산성범위에서 측정한다면 pH 10.01 대신 pH 4.01 용액을 사용하고 알칼리 범위에서 측정한다면 pH 4.01 대신 pH 10.01 용액을 사용한다.
② 정확한 보정을 위해 각 완충 용액에 두개의 비커를 사용한다.
한개는 증류수에 전극을 헹구고 나머지 한개는 보정을 위해 사용한다. 이런식으로 해서 Buffer 의 오염을 최소화시킨다.
③ 기기의 SWITCH를 ON하고 pH 전극과 온도 PROBE를 연결한다.
④ 비커 안에 온도 PROBE를 담그고 온도 측정을 표시하기 위해 C KEY를 누른다.
안정된 온도의 판독을 위해 잠시 기다린 후 Buffer의 온도를 기록한다.
⑤ pH KEY를 누른다. pH 전극을 증류수로 헹구고 pH 7.01 Buffer에 pH 전극을 담근 후 가볍게 흔들고 1분간 기다린다. 명시된 온도에서 액정판에 원하는 pH값이 표시 될 때까지 판넬 앞부분의 왼쪽 아래에 있는 "STD" TRIMMER를 드라이버로 돌려서 조정한다.
⑥ pH 전극을 증류수로 헹구고 pH 4.01 또는 pH 10.01 Buffer에 담근다.
가볍게 흔들고 1분간 기다린다. 명시된 온도에서 LCD에 원하는 pH 값이 표시될 때
까지 판넬 앞부분의 오른쪽 아래에 있는 "SLOP"를 드라이버로 돌려서 조정한다.
❋ pH미터기 보정이 필요한 경우
∙ pH 전극이 교체될 때
∙ 마지막 보정이후 한 달 기간의 경과 후에
∙ 전극이 열악한 조건에서 사용되어졌을 경우
∙ 세척 후, 기준 전해질(액)의 교체 시
∙ 최상의 정확성이 요구 될 때
2) 완충 용액
완충액이라고도 한다. 일반적으로 약한산과 그 염의 혼합용액 또는 약한 염기와 그 염의 혼 합 용액이 완충작용을 한다. 예를 들어 약한산인 아세트산과 그 염인 아세트산나트륨의 혼합액이 있다.
아세트산에 대해서는
- 참고문헌
-
- 일반화학 4th / 자유아카데미 / p.564~p.576
- 물리화학 8th / Oxford / p.245
- 물리화학실험 / 대한화학회 / 청문각 / p.96-98
- 물리화학 Robert A. Alberty / Robert J. Silbey / 사이텍미디어
- 분석화학 8th / 자유아카데미 / p.621,656
- 분석화학실험 / p.231
- Perry's Chemical Engineers' hand book 7th edition
- 화학 대사전 (5,7권) / 김창홍 외 5 / 世 和
자료평가
-
아직 평가한 내용이 없습니다.
오늘 본 자료
더보기

최근 판매 자료
- 심슨의 역설은 무엇인지(발생 원인 포함) 기술하고 우리 주위에서 발생한 사례를 찾아 요약 그 역설을 해결하여 올바로 해석
- 조명 디스플레이 - LED에 대해서
- [발광다이오드, LED, OLED, 플라스틱발광다이오드] 발광다이오드(LED)의 정의, 발광다이오드(LED)의 종류와 국내 발광다이오드(LED) 관련 사례 및 유기발광다이오드(OLED), 플라스틱발광다이오드(LED)에 관한 분석
- LED조명의 이해
- [열역학] 냉장고 증발기 시스템 열 효율성 고찰
- 충북대_일반물리학및실험1_7주차_역학적에너지보존
- [A+] razavi 마이크로 전자회로 4장 솔루션
- [실험] 전기용량과 유전율 측정
- 상하수도공학(구미서관) 연습문제 2장
- 이재수 수문학(구미서관) 연습문제 6장
저작권 관련 사항 정보 및 게시물 내용의 진실성에 대하여 레포트샵은 보증하지 아니하며, 해당 정보 및 게시물의 저작권과 기타 법적 책임은 자료 등록자에게 있습니다. 위 정보 및 게시물 내용의 불법적 이용, 무단 전재·배포는 금지됩니다. 저작권침해, 명예훼손 등 분쟁요소 발견시 고객센터에 신고해 주시기 바랍니다.









