[열역학] VLE(vapor-liquid equilibrium) Hexane, TAME계
 등록일 / 수정일
등록일 / 수정일 페이지 / 형식
페이지 / 형식 자료평가
자료평가 구매가격
구매가격
- 2010.07.13 / 2019.12.24
- 23페이지 /
 hwp (아래아한글2002)
hwp (아래아한글2002) - 평가한 분이 없습니다. (구매금액의 3%지급)
- 2,100원
최대 20페이지까지 미리보기 서비스를 제공합니다.
자료평가하면 구매금액의 3%지급!
 1
1 2
2 3
3 4
4 5
5 6
6 7
7 8
8 9
9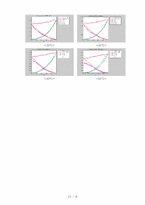 10
10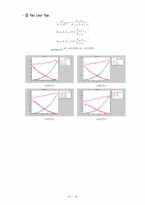 11
11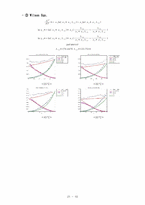 12
12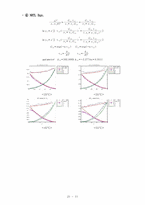 13
13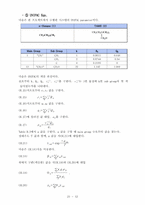 14
14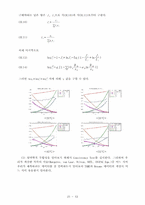 15
15 16
16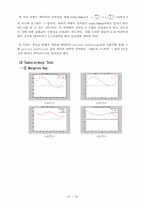 17
17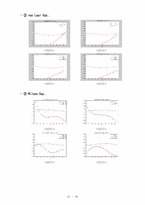 18
18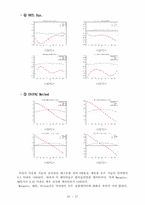 19
19 20
20
추천 연관자료
- 목차
-
❏ Introduction
❍ 개 요
❍ 목 적(Hexane/TAME계를 선정하게 된 이유)
❍ 방 법
❏ Theory
❍ 활동도 계수와 과잉 Gibbs 에너지에
대한 일반적 고찰
❍ 국부조성 모델 Wilson eqn.
& NRTL eqn.에 대한 고찰
❍ UNIFAC method에 대한 고찰
❏ Procedure / Result / Discussion
❍ VLE DATA Analysis
∙ , , vs 의 그래프
❍ 열역학적 부합성(일관성, Consistency)에
대한 설명
❍ Consistency Test
∙ P-x1-y1 선도
❍ Excess Property (GE, HE, TSE) Plot
❏ Conclusion
❏ Reference
❏ Program coding
별도첨부
❏ Introduction
- 본문내용
-
그러나 이 이론하에서 유도된 위의 식들은 분자크기가 비슷한 용액에 대하여는 잘 맞지만 실제의 많은 용액에 대하여는 잘 맞지 않았다. 따라서 보다 이론적인 배경을 가진 방법을 통하여 기-액 평형을 더 잘 예측할 수 있는 식들이 개발될 필요성이 있었다.
1964년 Wilson은 용액 내의 분자 크기 뿐만 아니라 분자간 인력도 각기 다르다는데 착안하여 국부조성(Local composition)을 도입하게 된다. 이는 구성 성분의 크기와 에너지 상태가 서로 다르므로 각 성분 분자 주위의 국부적인 환경이 용액 내의 거시적인 몰 특성과는 다르다는 개념을 기초로 한 것으로 이성분계 매개변수는 아직까지도 실험적인 값을 갖지만, 식의 형태로는 다성분계로의 확장이 가능하도록 되어있다. 이는 액체 용액 내에서 전체 혼합물의 조성과는 다른 국부조성이 분자의 크기와 분자 간의 작용력에서 기인하는 근거리 질서와 불규칙하지 않는 분자의 배향을 설명하기 위하여 가정된다. 이 개념은 그 이후에 Wilson식으로 알려진 용액거동의 모델을 발표하면서 VLE실험값을 상관시키는데 있어서 성공하게 된다. 따라서 이어서 다른 국부조성 모델들이 계속해서 발전하게 된다. Wilson식이 Athermal용액에서 출발한데 반하여 Heil은 Non-athermal용액에 대하여 Wilson식과 같은 방법을 제시하였다.
그 후 Wilson식이 완전 혼합용액에는 잘 맞지만 부분 혼합용액에는 잘 맞지 않는 단점을 보완하여 Scotchgard 와 Wilson은 three Parameter Wilson식을 제시하였고 Renon 과 Prausnitz는 Scott의 two liquid이론과 Guggenheim의 quasi-chemical theory에 local area fraction 개념을 도입하여 UNIQUAC(Unversal quasi-chemical)식을 제안하게 된다.
우리는 이러한 많은 국부조성개념에 근거한 식들 중에서 Wilson식과 NRTL(Non-Random Two Liquid)식을 사용하기로 결정하였으므로 지금부터 이 두 식에 대하여 자세히 살펴보도록 하겠다.
매우 광범위하게 이용하는 두 가지 파라미터식을 Wilson에 의해 최초로 제안되었고 수식화되었으며 orye와 prausnitz에 의해 실용화되었다. 두성분 및 다성분의 과잉 Gibbs 에너지형을 나타내는 wilson식은 아래와 같다.
2성분에 대한 대응 활동도 계수는 아래와 같이 표현된다.
Wilson식과 비교하여 NRTL의 중요한 이점은 완전한 혼합성계와 불완전한 혼합의 적용이다. 2성분에 대한 과잉 몰랄 Gibbs에너지는 아래의 식과 같다.
- 참고문헌
-
- J. M. Smith, H. C. Van Ness, M. M. Abbott.「Introduction to Chemical Engineering Thermodynamics」 7th ed. , Boston : McGraw-Hill, c2005.
- Robert H. Perry. 「Perry's chemical engineers' handbook」7th ed. , New York : McGraw-Hill, c1997.
- Palm, William J. (William John), 용호택 옮김. 「MATLAB 공학 응용」, 서울 : 아진, 1999
- O'Neil, Maryadele J. 「The Merck index : an encyclopedia of chemicals, drugs, and biologicals」13th ed., Whitehouse Station, NJ : Merck Research Laboratories, c2001.
- 박홍일, 『에탄올 혼합율이 가솔린 엔진의 배기와 성능에 미치는 영향』., 한국해양대 대학원 200402
- Armando del Rio, Baudilio Coto, Concepcion Pando, and Juan A. R. Renuncio,『Vapor-Liquid Equilibria for the Binary System Hexane + 1,1-Dimethylpropyl Methyl Ether at 298.15, 308.15, 318.15, and 328.15 K』, Industrial & engineering chemistry research, 2002, Vol.41 Issue 5, p1364-1369,
- Lohmann, J., Joh, R., Gmehling, J. 『From UNIFAC to Modified UNIFAC (Dortmund) 』, INDUSTRIAL AND ENGINEERING CHEMISTRY RESEARCH
2001, Vol.40 Issue 3, p957-964,
자료평가
-
아직 평가한 내용이 없습니다.










