[화학공학] 증류(distillation)와 추출(extraction)의 원리를 이용한 VLE와 LLE를 통해 물질의 상 분리와 상평형에 대한 이해
 등록일 / 수정일
등록일 / 수정일 페이지 / 형식
페이지 / 형식 자료평가
자료평가 구매가격
구매가격
- 2010.06.30 / 2019.12.24
- 53페이지 /
 hwp (아래아한글2002)
hwp (아래아한글2002) - 평가한 분이 없습니다. (구매금액의 3%지급)
- 2,000원
최대 20페이지까지 미리보기 서비스를 제공합니다.
자료평가하면 구매금액의 3%지급!
 1
1 2
2 3
3 4
4 5
5 6
6 7
7 8
8 9
9 10
10 11
11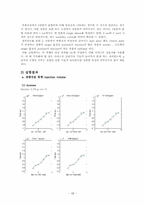 12
12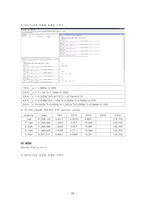 13
13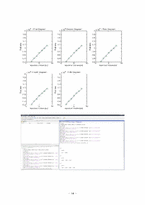 14
14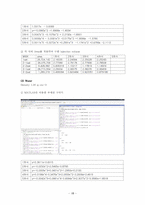 15
15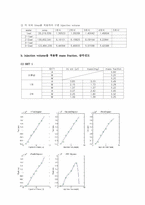 16
16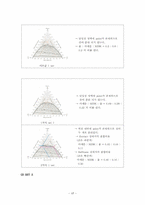 17
17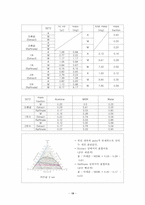 18
18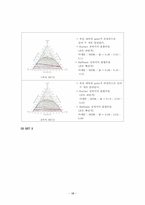 19
19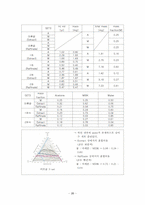 20
20
추천 연관자료
- 목차
-
목 차
[Refrigeration Cycle]
1. 실험목적
2. 이론
1) 물질의 성질(Aceton, MIBK)
a. MIBK
b. Acetone
(2) 추 출
(3) 증 류
(4) 평형의 성질
(5)정상상태와 평형의 차이
(6) 기-액 평형(vapor-liquid equilibria)
(7) 화학 퍼텐셜
(8) Raoult의 법칙
(9) fugacity(coefficient)
(10) activity coefficient
(11) 열역학적 부합성
3. 실험
Ⅰ LLE(Liquid-Liquid Equilibrium) 실험
1) 실험목적
2) LLE 실험의 전반적인 과정 요약
※ 삼각선도 그리는 방법
3) 실험결과
a. 검량선을 통한 injection volume
(1) Acetone
① MATLAB을 이용한 추세선 구하기
② 각 식에 Area를 적용하여 구한 injection volume
(2) MIBK
① MATLAB을 이용한 추세선 구하기
② 각 식에 Area를 적용하여 구한 injection volume
(3) Water
① MATLAB을 이용한 추세선 구하기
② 각 식에 Area를 적용하여 구한 injection volume
b. injection volume을 적용한 mass fraction, 삼각선도
(1) SET 1
(2) SET 2
(3) SET 3
(4) 이론값과 실험값의 mole fraction 비교
4) 결과 분석
5) 토의
Ⅱ VLE(Vapor-Liquid Equilibrium) 실험
1) 실험목적
2) VLE 실험의 전반적인 과정 요약
3) 실험결과
(1)Reference값
(2)라울의 법칙
(3)실험값
(4)수정된 라울의 법칙(Margules식 이용)
(5)수정된 라울의 법칙(Van larr식 이용)
(6)Reference와 Margules식을 이용한 라울의 법칙비교
(7)Reference와 Van larr식을 이용한 라울의 법칙비교
(8)Reference와 라울의 법칙비교
(9)Reference와 실험값비교
(10)상관관계(Margules식을 이용한 라울의 법칙)
(11)상관관계(Van larr식을 이용한 라울의 법칙)
4) 결과분석
5) 오차분석
6) 토의
5. 부록 - 추가적인 토의
1) 이론단수와 분배계수
2) activity 구하는 열역학적 식의 이해
3) 초임계 유체 추출(supercritical fluid extraction)
2. 초임계 유체의 용해도
3. 초임계 유체의 용매로서의 장점
4. 초임계 유체의 단점
5. 초임계 용매의 선정
6. 응용 분야
4) VLE실험 오차관련 열역학적 부합성 부분
6. 참고문헌
- 본문내용
-
[Refrigeration Cycle]
1. 실험목적
가. 가시적으로 판별하기 힘든 평형의 원리를 온도, 압력 등의 조작변수와 연동하여 상평
형에 대해 이해한다.
나. 실험적으로 얻어낸 데이터와 문헌데이터 값을 비교하여 기-액 평형 및 증류에 대한
기초 지식을 습득한다.
다. Liquid-Liquid System의 액-액 평형을 통하여 상평형 및 추출과 관련한 이론을 습득
한다.
라. 기체 크로마토그래피(GC)의 원리와 사용법을 익힌다.
2. 이론
1) 물질의 성질(Aceton, MIBK)
a. MIBK
MIBK 분자량은 100.16으로 무색투명의 액체다. 방향취가 있으며 알코올, 에테르, 벤젠 등 대부분의 유기용제 및 동식물유에 쉽게 녹는다. 비중은 0.802(20℃), 증기밀도 3.45(공기=1), 비점 116℃, 융점 -18.3℃, 인화점 14℃(밀폐)·25℃(개방), 폭발한계 1.2∼8.0%(공기 중의 용량%), 용해성 1.7∼2%(20℃)이다. 미세한 케톤 냄새가 있으며 물에 잘 용해되지 않는다.(20℃에서 1.6g/100g) 증기압은 16mmHg(20℃), 발화점은 448℃이다. 본 제품은 분자 중에 카르보닐기와 인수소원자를 가지므로 화학적 반응성이 풍부하다. 크롬산과 같은 강력한 산화제로서 산화하면 초산, 이소초산, 이소길초산, 이산화탄소, 물이 얻어진다. 또 적당한 촉매에서 공기, 수증기와산화하면 디케틴이 얻어진다. 니켈과 동, 클로마이드 촉매하에서 수소를 작용시키면 메틸이소카르비놀(MIBC)이 얻어지며, 이것은 도료용 용제나 여러 가지 에스테르류의 원료에 사용된다. MIBK는 여러 가지 촉매에 사용하면 단독에서도 축합되지만 알데히드류와의 축합물을 수소첨가를 하게 되면 알코올류로 된다. 이것은 계면활성제의 중간품으로서 유용하다.
b. Acetone
탄소가 산소와 이중결합을 하고 있고, 그 탄소가 또 다른 두 개의 결합자리를 가지고 있어 두 알킬기(alkyl group)들과 결합하고 있는 경우, 이 물질을 케톤(ketone)이라 한다. 케톤의 가장 간단한 형태로, 양쪽에 하나씩 총 두(di)개의 메틸기(metyl)와 결합하고 있기 때문에 다이메틸케톤(dimethylketone)이라고 부르기도 한다. 또 탄소가 총 세 개인 프로페인(propane)에서 변형된 케톤(ketone)이라는 의미에서 프로판온(propanone)이라고 부르기도 한다.
화학식 CH3COCH3. 분자량은 58.08으로, 향기가 있는 무색의 액체이다. 물에 잘 녹으며, 유기용매로서 다른 유기물질과도 잘 섞인다. 그래서 물로 세척이 되지 않는 물질을 아세톤으로 처리하면 쉽게 세척할 수 있어 일상 생활에 많이 사용된다. 예를 들어, 페인트를 지우는 데 쓰이며, 손톱에 바른 에나멜을 지우는 데에도 많이 쓰인다. 그렇지만 인화성이 강해 불이 잘 붙으며, 폭발의 위험이 있기 때문에 불에 가까이 두어서는 안 된다. 2차알코올인 아이소프로판올을 산화시키면 얻을 수 있다. http://100.naver.com/100.nhn?docid=105063
- 참고문헌
-
1) J. M. Smith and H. C. Van Ness,"Introduction to Chemical Engineering
Thermodynamics", The McGraw Hill Companies, Inc., New York, 422-437p,
442-456p, (1996).
2) J. Gmehling, "Vapor-Liquid Equilibrium Data Collection; Chemistry Data Series",
DECHEMA, Frankfurt, Vol.1,part 1a 53p, (1981).
3) 정용순 외, “기기분석”, pp.501-509, 반도출판사(1997).
4) 김화용 외 역, “화학공학열역학”, pp.29, McGraw Hill Korea(2003).
5) 이화영 외 역, “단위조작”, pp.747, McGraw Hill Korea(2002).
자료평가
-
아직 평가한 내용이 없습니다.










