[화학공학] 회분식반응기를 이용한 반응속도 상수의 결정
 등록일 / 수정일
등록일 / 수정일 페이지 / 형식
페이지 / 형식 자료평가
자료평가 구매가격
구매가격
- 2010.01.12 / 2019.12.24
- 7페이지 /
 hwp (아래아한글2002)
hwp (아래아한글2002) - 평가한 분이 없습니다. (구매금액의 3%지급)
- 1,100원
최대 20페이지까지 미리보기 서비스를 제공합니다.
자료평가하면 구매금액의 3%지급!
 1
1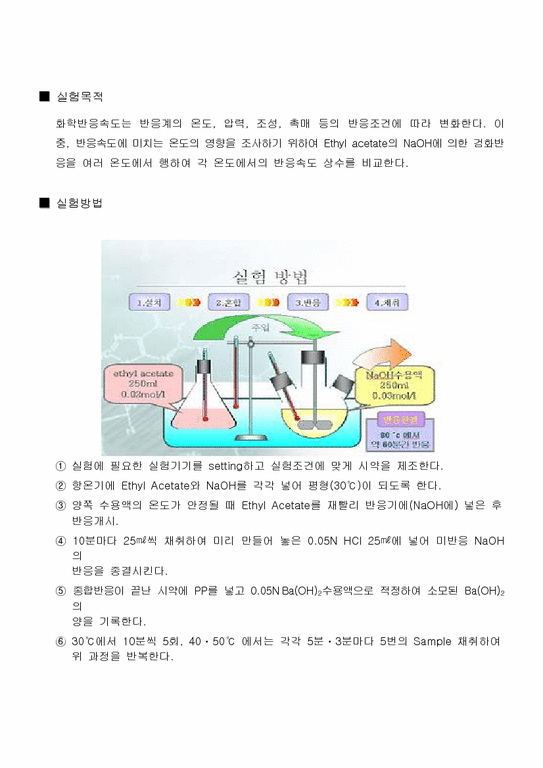 2
2 3
3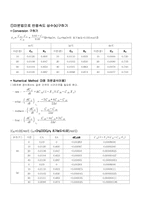 4
4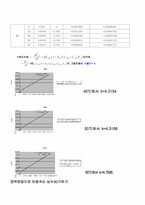 5
5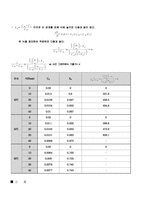 6
6 7
7
추천 연관자료
- 목차
-
실험목적
실험방법
실험결과
*미 반응 NaOH의 농도 구하기
*NaOH 농도(CA) 그래프
①미분법으로 반응속도 상수(k)구하기
* Conversion 구하기
* Numerical Method (3점 차분공식이용)
②적분법으로 반응속도 상수(k)구하기
고 찰
참고문헌
- 본문내용
-
실험결과
*미 반응 NaOH의 농도 구하기
( HCl 의 몰수 : 0.05 mol , Ba(OH)2 의 농도 : 0.05 N )
40℃
50℃
60℃
시간(분)
소모된
Ba(OH)2
미반응
NaOH
시간(분)
소모된
Ba(OH)2
미반응
NaOH
시간(분)
소모된
Ba(OH)2
미반응
NaOH
10
19
0.0120
10
19.5
0.0110
10
20.8
0.0084
20
19.6
0.0108
20
19.75
0.0105
20
21
0.0080
30
19.8
0.0104
30
19.95
0.0101
30
21.1
0.0078
40
20
0.0100
40
20.1
0.0098
40
21.15
0.0077
*NaOH 농도(CA) 그래프
①미분법으로 반응속도 상수(k)구하기
* Conversion 구하기
(A=NaOH, CA0=NaOH의 초기농도=0.03[mol/l])
40℃
50℃
60℃
시간(분)
CA
XA
시간(분)
CA
XA
시간(분)
CA
XA
10
0.0120
0.600
10
0.0110
0.633
10
0.0084
0.720
20
0.0106
0.647
20
0.0105
0.650
20
0.0080
0.733
30
0.0104
0.653
30
0.0101
0.663
30
0.0078
0.740
40
0.0100
0.667
40
0.0098
0.673
40
0.0077
0.743
* Numerical Method (3점 차분공식이용)
: 3점차분 공식에서는 같은 간격의 시간간격을 필요로 한다.
․ rate :
․ initial :
․ midterm :
․ final :
- 참고문헌
-
- 화학공정실험 2학기
- Naver지식in
- 한국화학공학회 홈페이지.
자료평가
-
아직 평가한 내용이 없습니다.










