[분석화학] 미지시료 전위차 적정
 등록일 / 수정일
등록일 / 수정일 페이지 / 형식
페이지 / 형식 자료평가
자료평가 구매가격
구매가격
- 2008.09.19 / 2019.12.24
- 22페이지 /
 ppt (파워포인트 2003)
ppt (파워포인트 2003) - 평가한 분이 없습니다. (구매금액의 3%지급)
- 1,800원
최대 20페이지까지 미리보기 서비스를 제공합니다.
자료평가하면 구매금액의 3%지급!
 1
1 2
2 3
3 4
4 5
5 6
6 7
7 8
8 9
9 10
10 11
11 12
12 13
13 14
14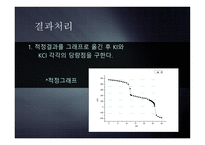 15
15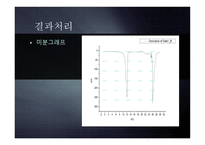 16
16 17
17 18
18 19
19 20
20
추천 연관자료
- 목차
-
1.실험 목적
2.실험 개요
3.용어 정리
4.실험 원리
5.기구 및 시약
6.실험순서
7.결과처리
8.주의사항
9.참고문헌
- 본문내용
-
실험 목적
미지시료 안에 들어있는 Cl-와 I- 양을
전위차 적정을 통해 알아낸다.
실험 개요
두 물질의 혼합물을 적정할 때,
Ksp 가 작은 물질이 먼저 침전되는 원리를 이용하여 두 물질을 적정한다.
침전이 진행될 때 pH meter를 이용해서
기준전극과 지시전극간의 전위차를 측정한다.
이를 적정곡선으로 그려 2개의 종말점을 찾아내어
미지시료 안의 KCl과 KI의 양을 구한다.
침전 적정 (Precipitation Titration)
침전 반응을 이용하는 분석법으로서 가장 대표적인 침전 적정법으로는 은이온과 할로겐 이온이 반응하여 할로겐화은 침전을 형성하는 은적정법이있다.
전위차 적정
시료용액이 형성하는 전지의 전위를 측정하여 시료용액을 분석하는 방법.
- 참고문헌
-
쉽게 배우는 대학분석화학 (신봉기 외 공역, 형산출판사, 2002)
최신분석화학 (김강진 외 공역, 자유아카데미, 1999)
분석화학 (이용근, 이동수 외 공역, 희중당, 1992)
분석화학 (안정수 외 공역, 창문각, 2001)
분석화학 (송연호 외 공역, 아덱스, 2007)
자료평가
-
아직 평가한 내용이 없습니다.










